√無料でダウンロード! 価電子の数 表 314716-価電子の数 表
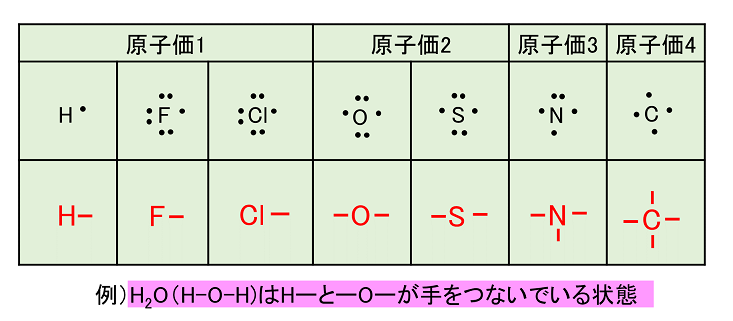
価電子を記号・で表した表記法 1 2 13 14 15 16 17 Li Be B C NOF 不対電子 P14 電子式と価電子・原子価 原子価:不対電子の数:手の数 P14 イオン(陽イオン) 原子が電子を放出すると陽イオンになる Na →Na eナトリウム ナトリウムイオン イオン式 Al3 (アルミニウムイオン)希ガスの原子の最外殻電子の数は,He では2 個,そのほかでは8 個である。しか し,希ガスの原子の価電子の数は,いずれも0 個とする。 問 次の各原子の電子配置を,(例)にならって記せ。また,価電子の数も答えよ。 (例) 6 C;K2,L4 (1) 9 F (2) 13 Al (3) 18 Ar (4Mar 16, 21 · 化学の価数についての質問です。この表の価電子数がどう決まっているのかが分かりません。価電子数は最外殻電子数という認識でいます。例えば、oの最外殻電子数は6だから価電子数は6、なのにo²の価電子数は2っていうのが分かりません。

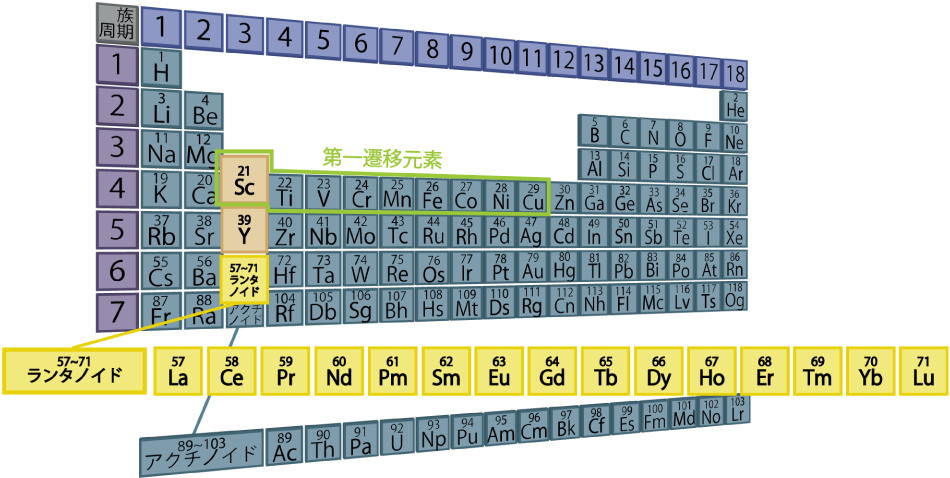
2 希土類元素 ランタノイド
価電子の数 表
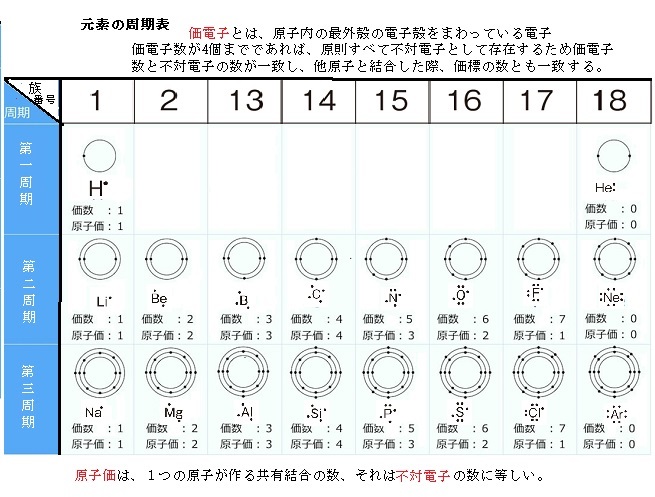
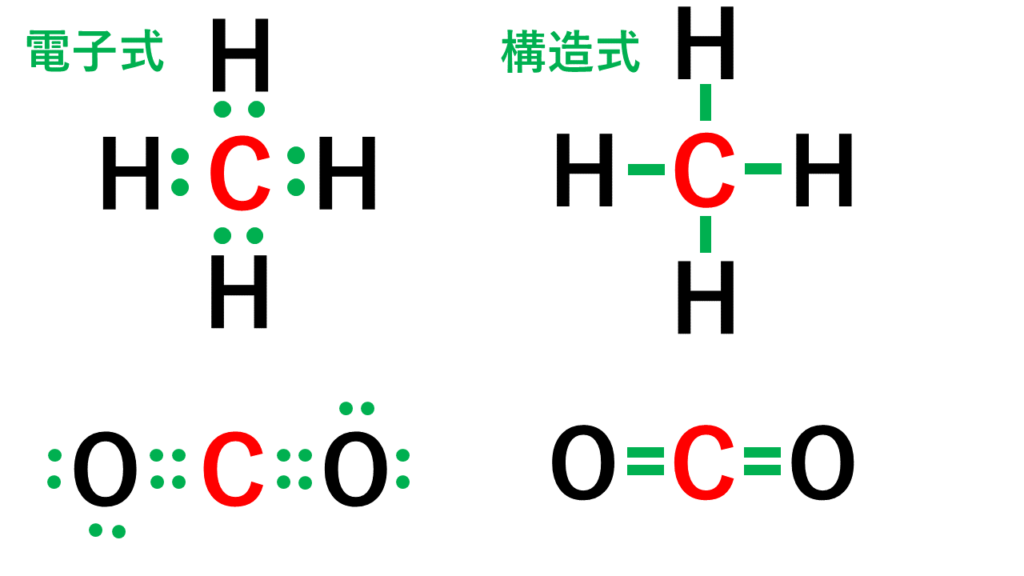
価電子の数 表-Oct 13, 18 · 価電子数が4つなので、すべて不対電子となります。 例えば、メタンCH 4 の場合、不対電子4つと水素が共有結合し、4本の共有結合が生じます。 炭素原子Cからは、価標(棒線)が4本出ています。 二酸化炭素CO 2 の場合、二重結合となりますが、同様に炭素原子Cからは、価標(棒線)が4本出ています。Cの価電子数= 4 (2s22p2) 例)CO2 1)分子の総価電子数(V)を計算する = 4 (2s Oの価電子数= 6 (2s22p4) 総価電子数 = 42x6 = 16 2)共有結合の数(Nb)を計算する イオンの場合は電荷に応じて増(陰イオン) 減(陽イオン)する Nbc = (8x316)/2 = 4 n原子分子なら Ncb = (8nV)/2




Q1 Descubre Como Resolverlo En Qanda
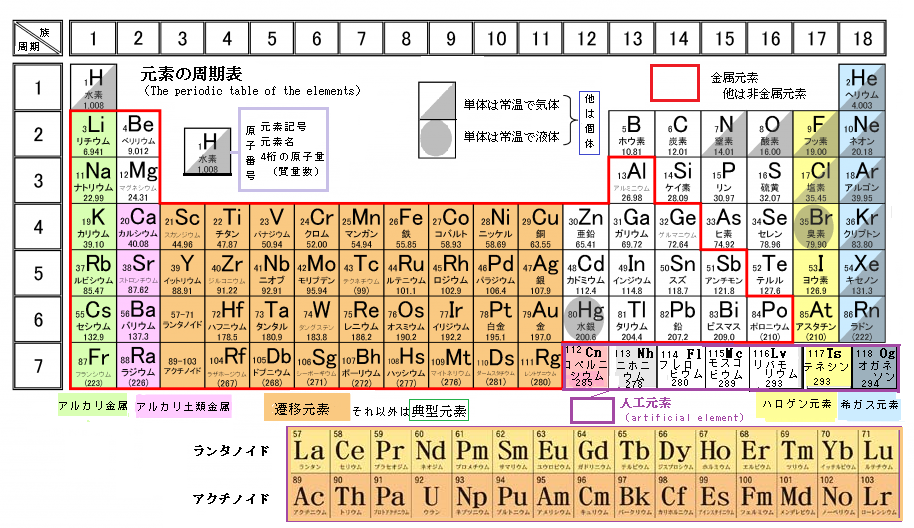
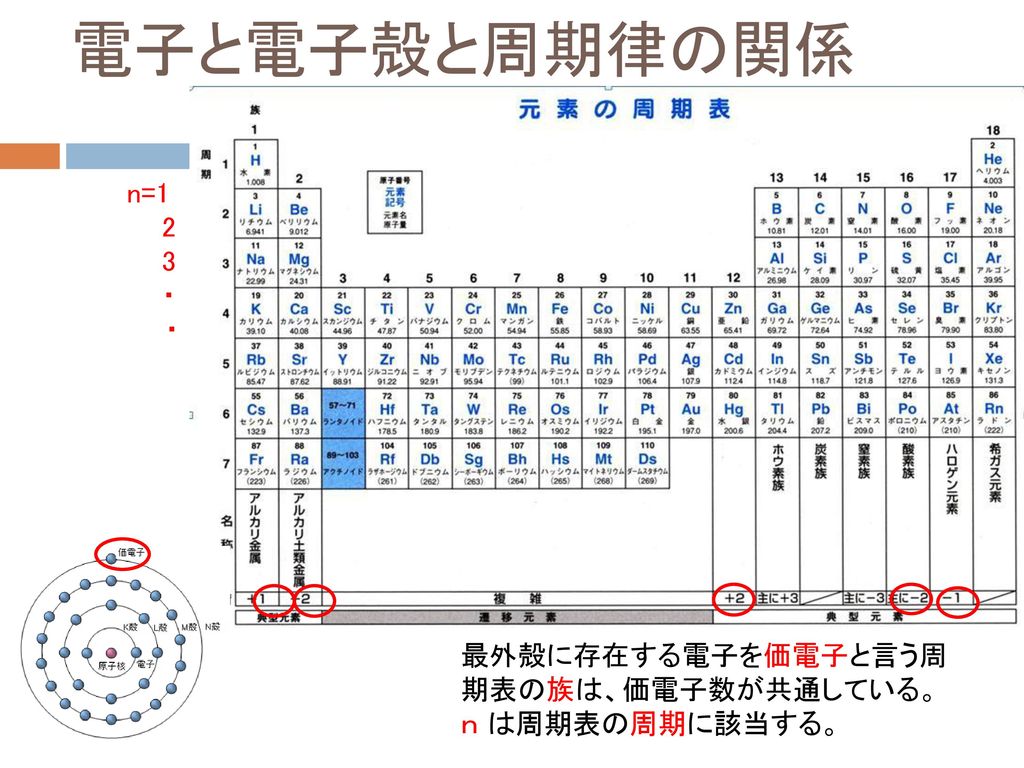
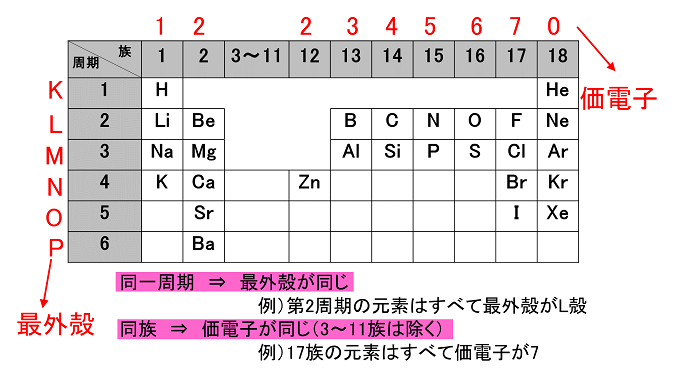
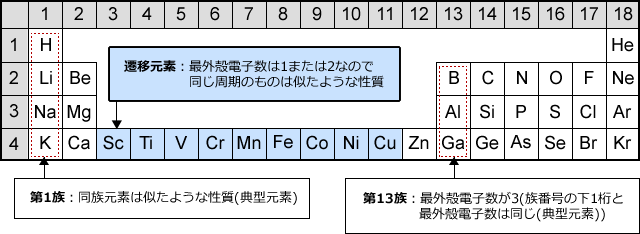
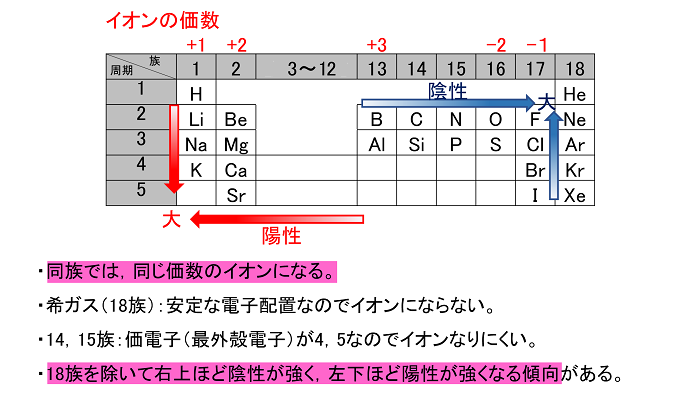
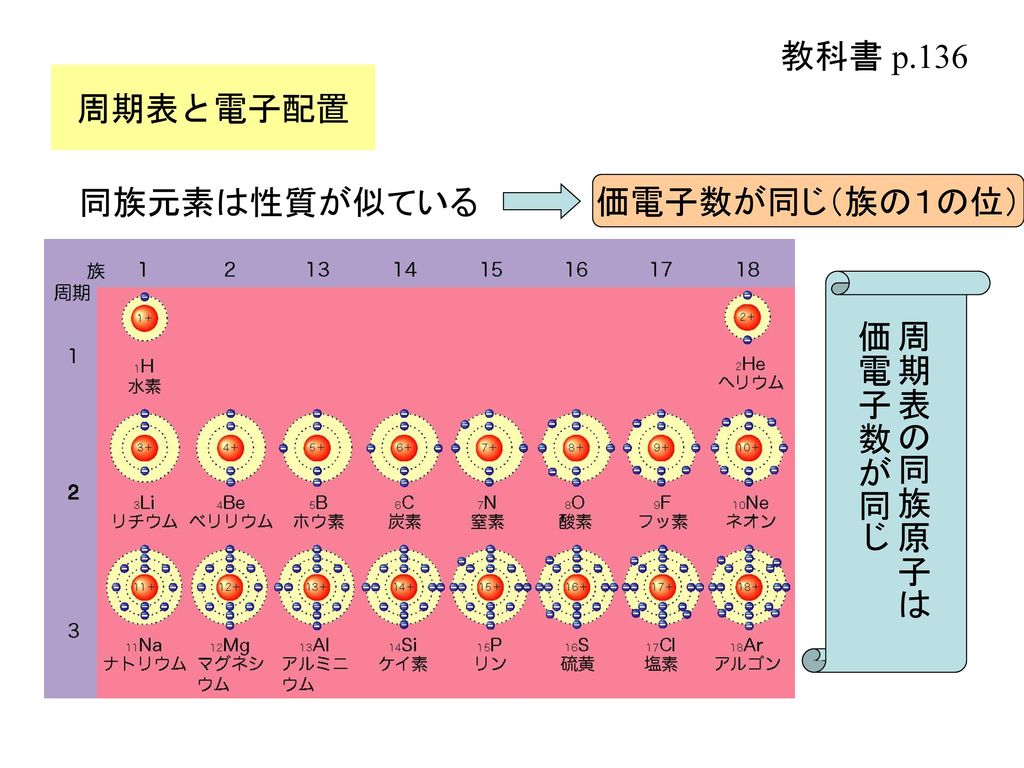
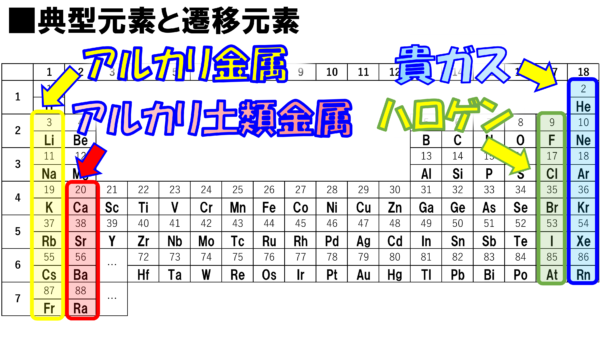
錯体の価電子数= 金属の価電子数(d電子数) +配位子からの供与電子数 オクテット則を遷移金属元素を含む化合物へ拡張したものが18 電子則であるが,詳しくは分子軌道法を用いて理解することがで きる。その概略を右図に示す。周期表と電子配置 イオンの生成 多くの原子は,不安定で単独では存在できない。 安定な原子は,最外殻の電子数が8個(価電子0)の貴ガス元素だけである。 そこで不安定な原子は安定化するため,最外殻の電子(-の粒子)を放出したり,受け取っApr 17, 21 · 原子番号順に元素を並べ、性質の似た元素が縦列に並ぶようにした表 を 周期表 と呼びます。 縦の列 を 族 と呼び、 横の行 を 周期 といいます。 同族であれば価電子数が同じなので化学的性質が似ています 。
例えば,周期表の 1族の元素の原子はどれも価電子の数が1個ですが,このうちLi,Na,K,Rb,Cs はどれも金属元素で,1価の陽イオンになりやすく,酸化されやすく,水と反応しやすいなど,よく似た性質をもっています(これらの元素をアルカリ金属元素といいます)。 17族の元素 F,Cl,Br,I の原子は価電子の数が7個で,1価の陰イオンになりやすく,金属元素と形式酸化数、価電子数 Mn(I) (d6) MeCO (x5) 価電子数 6e 2e 10e 18e Mn (d7) Me CO (x5) 価電子数 7e 1e 10e 18e 金属―配位子間を実線で結ぶ (共有結合を表す) MnMe 中性のMnとMe・が1電子ずつ 出し合って結合を形成 MnCO :CO配位子から2電子 結合に必要な電子対が配位子側次の各原子の価電子の数を記せ。 (1)1H (2)3Li (3)6C (4)8O (5)10Ne (6)11Na (7)16S
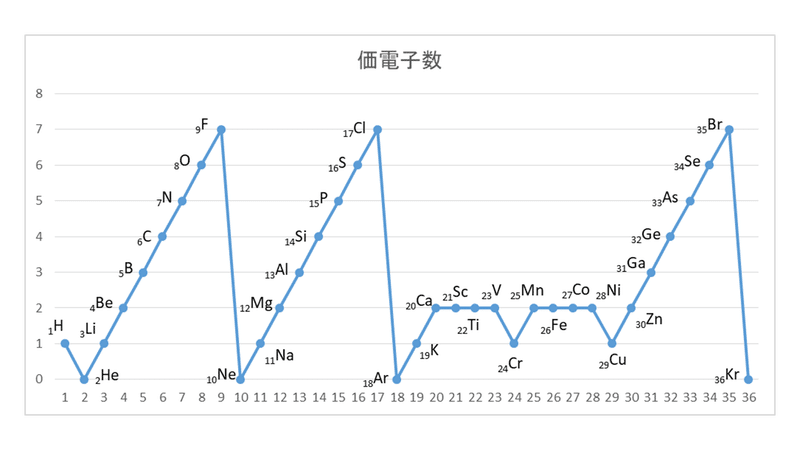
・原子番号までの単原子イオンの電荷は上記の周期表からも分かるが,原子番号21以上の主要な元 素と多原子イオンは,そのまま暗記する必要がある。 ・電荷は,イオン式の右上に書く。価数を前に+-を後に書く。ただし,1価の場合は価数を省略す る。化学辞典 第2版 価電子の用語解説 原子価電子ともいう.他電子との間の電子対結合に関与している電子をいう.一般に,化学結合は互いに1個の電子をだしあって共有することにより形成されるから,原子の価電子は孤立した不対電子でなければならない.したがって,価電子の数はそ第10族元素(だいじゅうぞくげんそ、Group 10 element)はIUPAC形式での周期表における第10族に属する元素の総称。 ニッケル・パラジウム・白金・ダームスタチウムがこれに分類される。 長周期表の第8族〜第10族元素は最外殻の4s電子を2つ持ち、短周期表で VIII族、あるいは VIIIB族としてまとめ




高校化学基礎 周期律と価電子 映像授業のtry It トライイット



Http Oec Chembio Nagoya U Ac Jp Pdfs 17 Orgmet 01 Handout Pdf
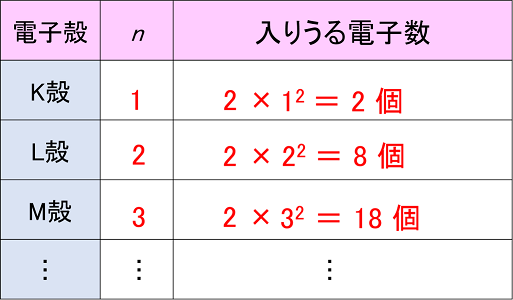
「最外殻電子」:共有している電子を「2個」と数える 「価電子」:共有している電子を「1個」と数える h o h h o h 「最外殻電子」 「価電子」 2個 8個 2個 1個 6個 1個 用途:オクテット則の判定 用途:総電子数の確認 12に格子点数の2倍 となる(原 子数の2倍 とは限らないこと に注意!) さて,各 格子点に1個 の価電子を持った原子を置き,そ の電子が自由電子として結晶中を動き回るとすれば,そ のエ ネルギーはk2に 比例するので,全 電子はk空 間で,半 径kF☆ 一般的に、 価電子数 = 最外殻電子数 = 周期表の族の番号の1の位の数 (outermost electron) 例外希ガス(貴ガス)は、価電子数= 0、最外殻電子数= 2 または 8 価電子数が等しい原子は、化学的性質が似ている ☆次の電子配置は安定(重要)




原子価とは 原子価の求め方までわかりやすく解説 高校生向け受験応援メディア 受験のミカタ



周期律と周期表 覚書
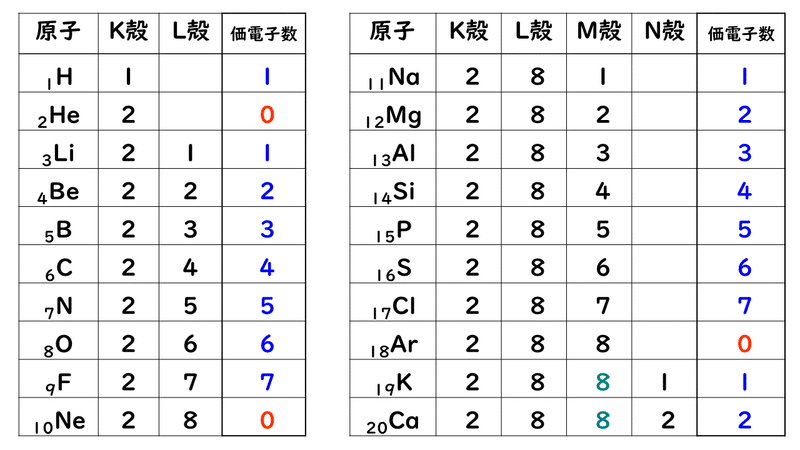
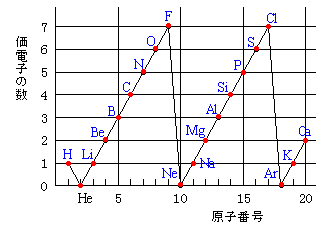
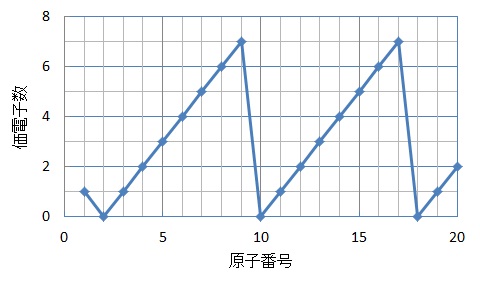
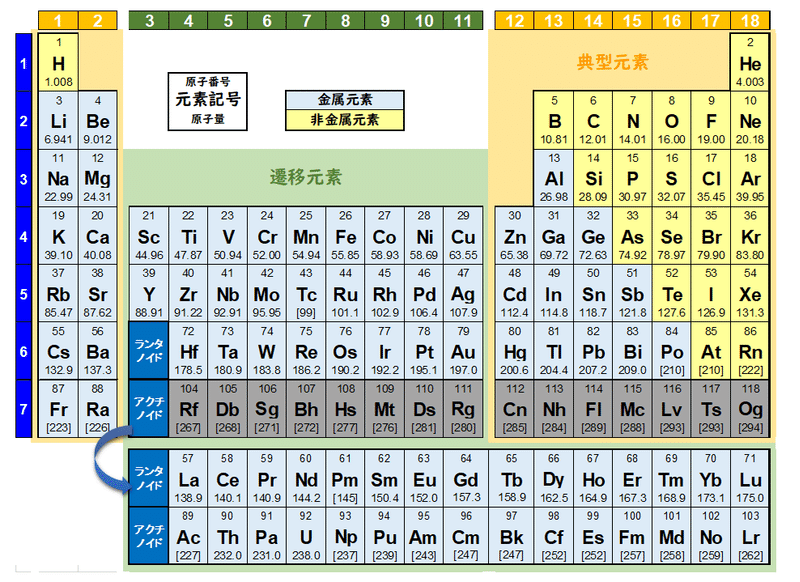
原子番号と価電子の数 P16 元素の周期表 P17 価電子数 (a) (b) (c) (d) (e) (f) (g) 4.周期表 H 図は周期表の各元素群のおおよその分類を示したものである。 (1)典型元素はどの部分か。すべて記せ。横軸は、 原子番号 になっています。 縦軸は、 価電子の数 になっていますね。 たとえば、原子番号1のH(水素)は、価電子の数が「1」です。 原子番号2のHe(ヘリウム)は、価電子の数が「0」です。 Heは、希ガスだったので、価電子の数は「0」なのですね。 その続きは、次のように順番に増えていきます。 Li(リチウム) 「1」 Be(ベリリウム) 「2」 B実際は価電子数4と5の原子は存在し難いのだが、例えばZr 4+ 、Ti 4+ 、Th 4+ などは強い加水分解傾向を有するのでpH0などの強酸性下では溶液中でも存在するので、絶無と言うわけではない。 価電子数を表した表



価電子 Chemihack おうちで学べる化学



車山高原レア メモリーが語る 元素の周期表
Aug , · 価電子は基本的には最外殻電子のことですが、 最外殻が閉殻しているまたは最外殻電子が8個のとき、価電子とは呼びません。 そしてこの 最外殻が閉殻しているまたは最外殻電子が8個の原子を希ガス といいます。Apr , 21 · 価電子数と原子価の違い 価電子とは最外殻に存在する電子の数のことです。 価電子数が4個までであれば、原則すべて不対電子として存在するため価電子数と不対電子の数が一致し、他原子と結合した際、価標の数とも一致します。元素 価電子数 表 周期表 Wikipedi 電子軌道周期表 周期 族または元素名 軌道名 1 1と18 1s 2 1と2 2s 1318 2p 3 1と2 3s 1318 3p 4 1と2 4s 312 3d 1318 4p 5 1と2 5s 312 4d 1318 5p 6 1と2 6s ランタノイド元素 4f 312 5d 1318 6p 7 1と2 7s アクチノイド元素 5f 312 族と価電子数を、表にまとめ




Q1 Descubre Como Resolverlo En Qanda



Numb016
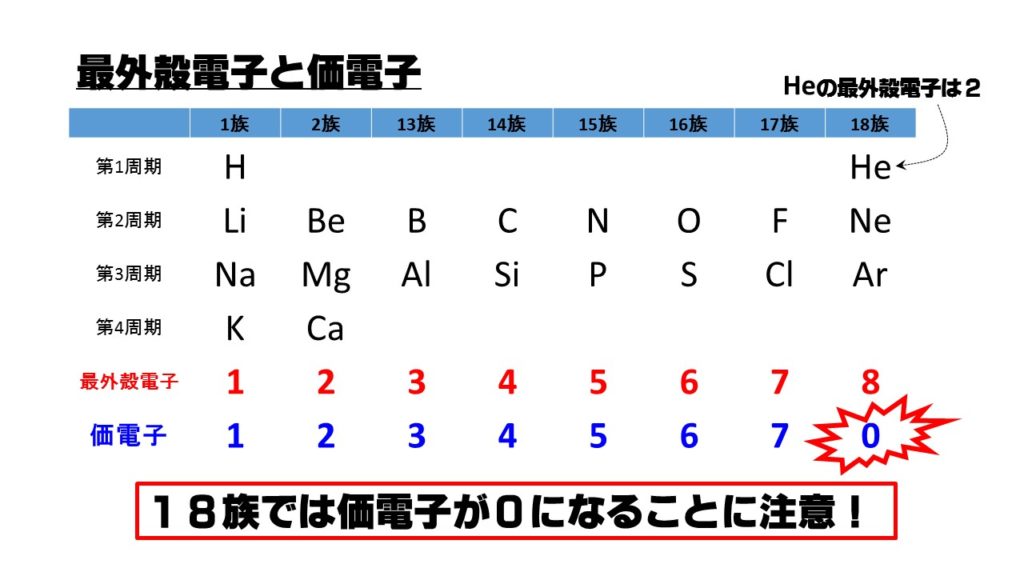
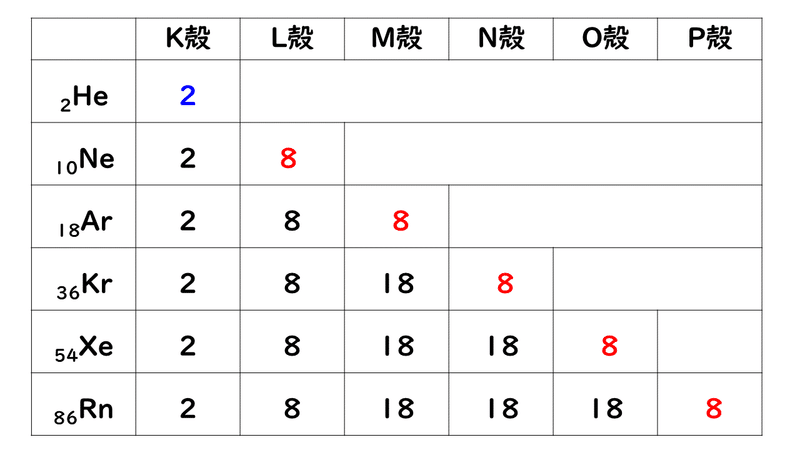
「価電子の数 = 最外殻電子の数」となる。 希ガス原子 0 とする。「価電子の数 ≠ 最外殻電子の数」となる。 窒素原子 7n とアルゴン原子 18 ar について,それぞれ次の問いに答えよ。 問1 k 殻,l 殻,m 殻には,電子がそれぞれ何個入っているか。 問2 価「価電子」 とは、 最外殻にある1から7個の電子 のことです。 「価電子」と「最外殻電子」はよく似ていますが、 「1から7個」 というところが非常に重要です。 今回のCとFの場合は、どちらも「1から7個」の中に収まっています。形式酸化数、価電子数 Mn(I) (d6) MeCO (x5) 価電子数 6e 2e 10e 18e Mn (d7) Me CO (x5) 価電子数 7e 1e 10e 18e 金属―配位子間を実線で結ぶ (共有結合を表す) MnMe 中性のMnとMe・が1電子ずつ 出し合って結合を形成 MnCO :CO配位子から2電子 結合に必要な電子対が配位子側から供与



Http Www Lst Hokkai S U Ac Jp Kubo Pdf Mat3 Pdf




高校化学基礎 原子価とは 映像授業のtry It トライイット
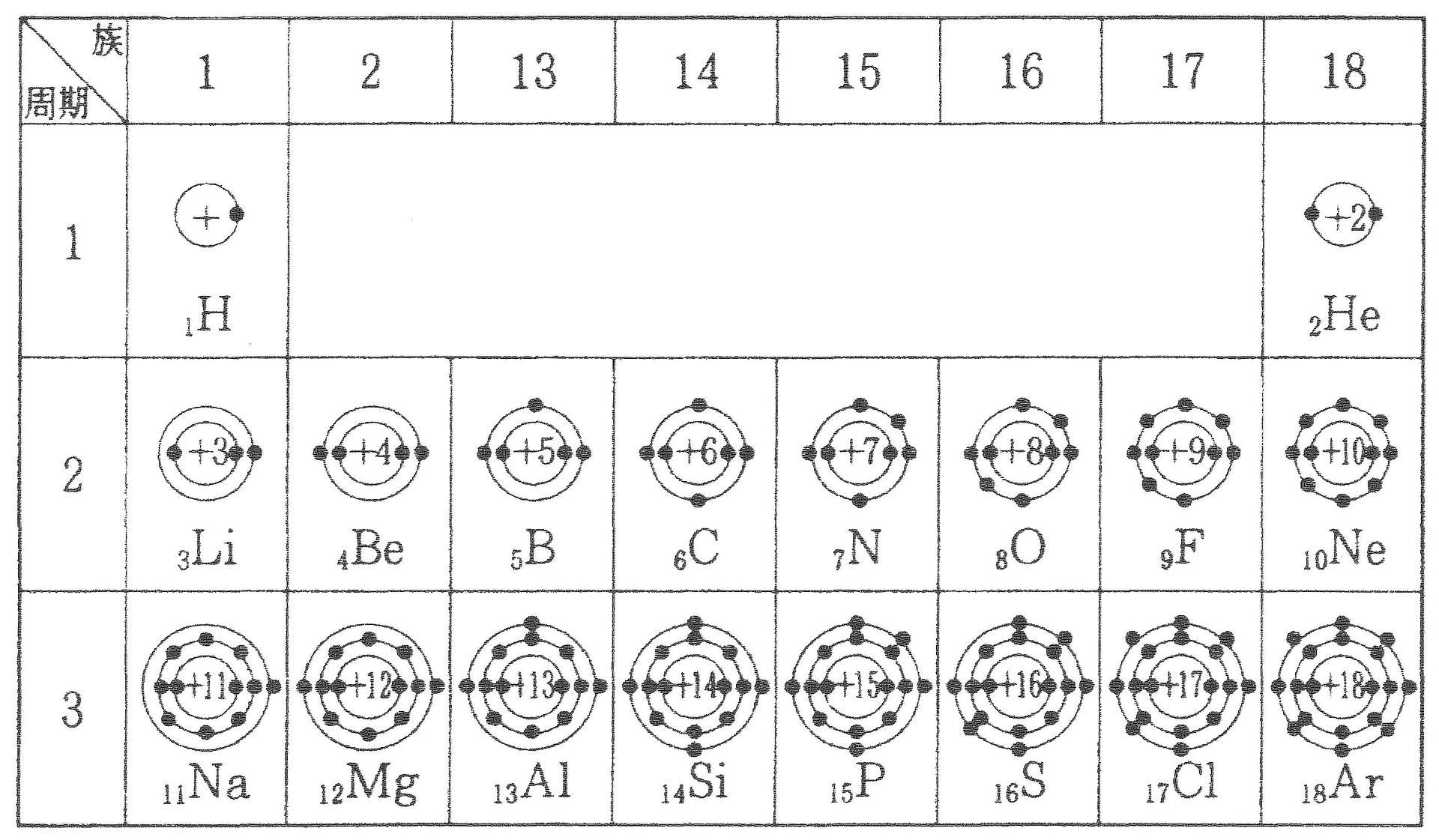
また、価電子の数も書け。 K殻 L殻 M殻 N殻 価電子の数 (例) 6 C ( 2 ) ( 4 ) --- --- ( 4 )個Sep 14, 18 · だけども、最外殻電子数と価電子数が違う奴らもいるんです。そいつらが、「希ガス」です。 この18族元素たちを希ガスといい、この希ガスは、最外殻電子と価電子が一致しません。 希ガスの価電子は全て0 です。考える 。電子が存在している層を殻殻殻殻(shell) という 。 ・殻に入り得る電子の数:2n2 (n主量子数 ) ・殻に電子が詰まった状態 :閉閉殻殻閉殻 (closed shell) 一番外側の軌道を最外殻 といい 、そこに存 在している電子を価電子 (valence electron) と 呼ぶ。



宮崎技術研究所 の技術講座 電気と電子のお話 4 1 1




最外殻電子と価電子の違いは 化学受験テクニック塾
Feb 06, 10 · 典型元素では,最外殻の電子数が族番号の 1 桁目と一 致しており,価電子を除いた内側の電子殻は, s 2 p 6 の希ガスの電子配置か, s 2 p 6 d 10 の 電子配置をとる。たとえば,第 3 周期元素では,ネオンの電子配置 (1s 2 2s 2 2p 6) の外側 の電子殻 (3s , 3p) に価電子帯の電子が ンド(伝導帯)に遷移 電子 ホール(正孔) ホール=電子の抜け殻 運動量、エネルギー、 有効質量、電荷 ・・・元の電子に対し、抜け殻 で考えると符号が変わる 伝導帯 価電子帯 t > 0 伝導帯下端 価電子帯上端 106




化学 原子の構成 周期表 これを読めば時短で簡単に全部わかる Youneed




高校化学基礎 元素の周期表 映像授業のtry It トライイット




高校化学基礎 希ガスの電子配置 映像授業のtry It トライイット



分子と共有結合
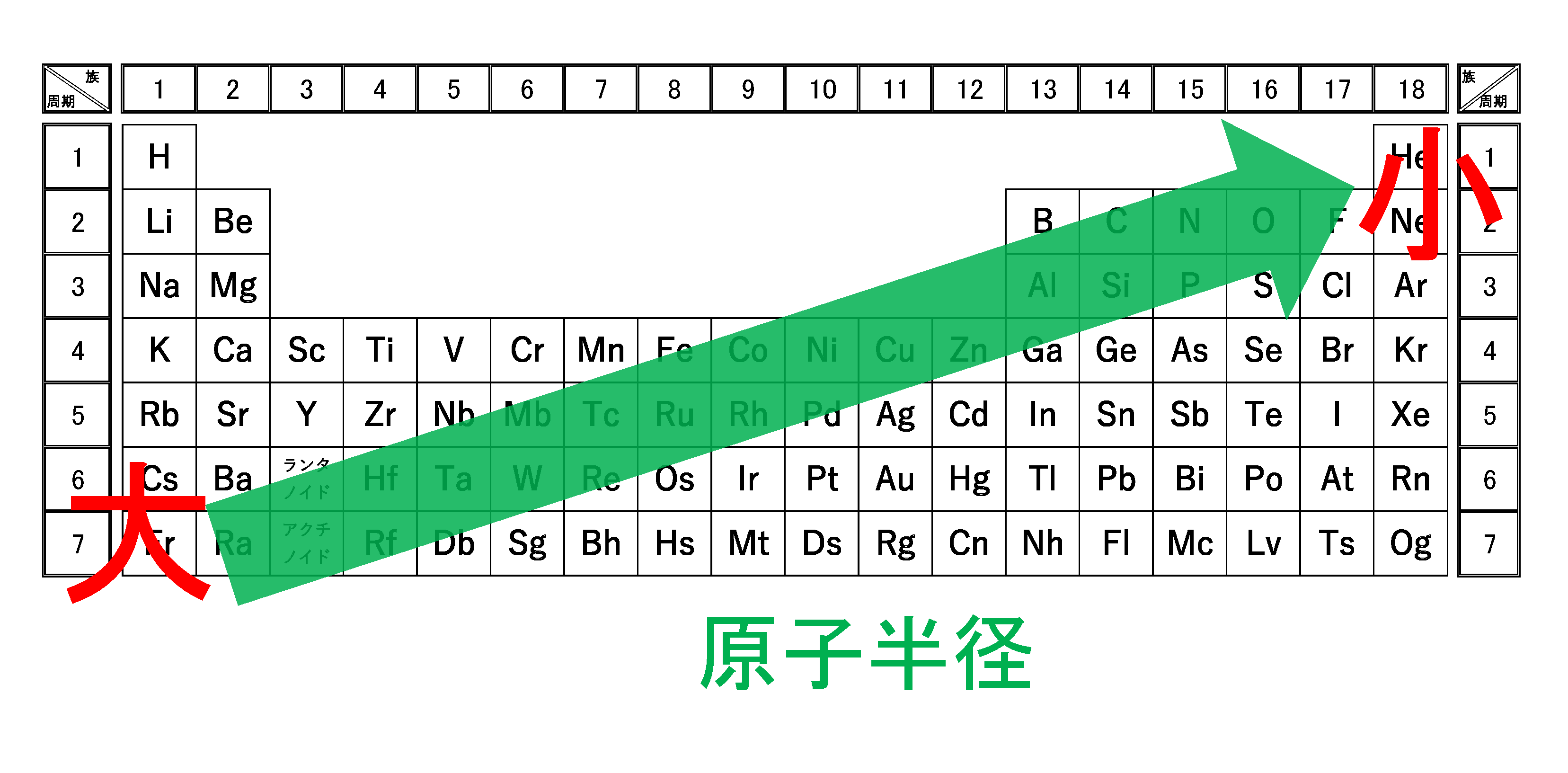



3分でわかる 原子半径 原子の大きさ の周期表での大小関係とその理由を図で徹底解説 サイエンスストック 高校化学をアニメーションで理解する



教養の化学 第5週 13年10月21日 担当 杉本昭子 Ppt Download



3




周期表と覚え方 原子量 語呂合わせ 理系ラボ




第3節 元素の周期表




遷移元素の特徴 遷移元素のk殻 l殻 m殻 化学 By 藤山不二雄 マナペディア




イオンの構造と電子配置を軌道と共に学ぶ 電荷密度や 安定なイオンの種類についてもわかりやすく解説



Http Www E Net Nara Jp Hs Gojo Index Cfm 1 1063 C Html 1063 Pdf
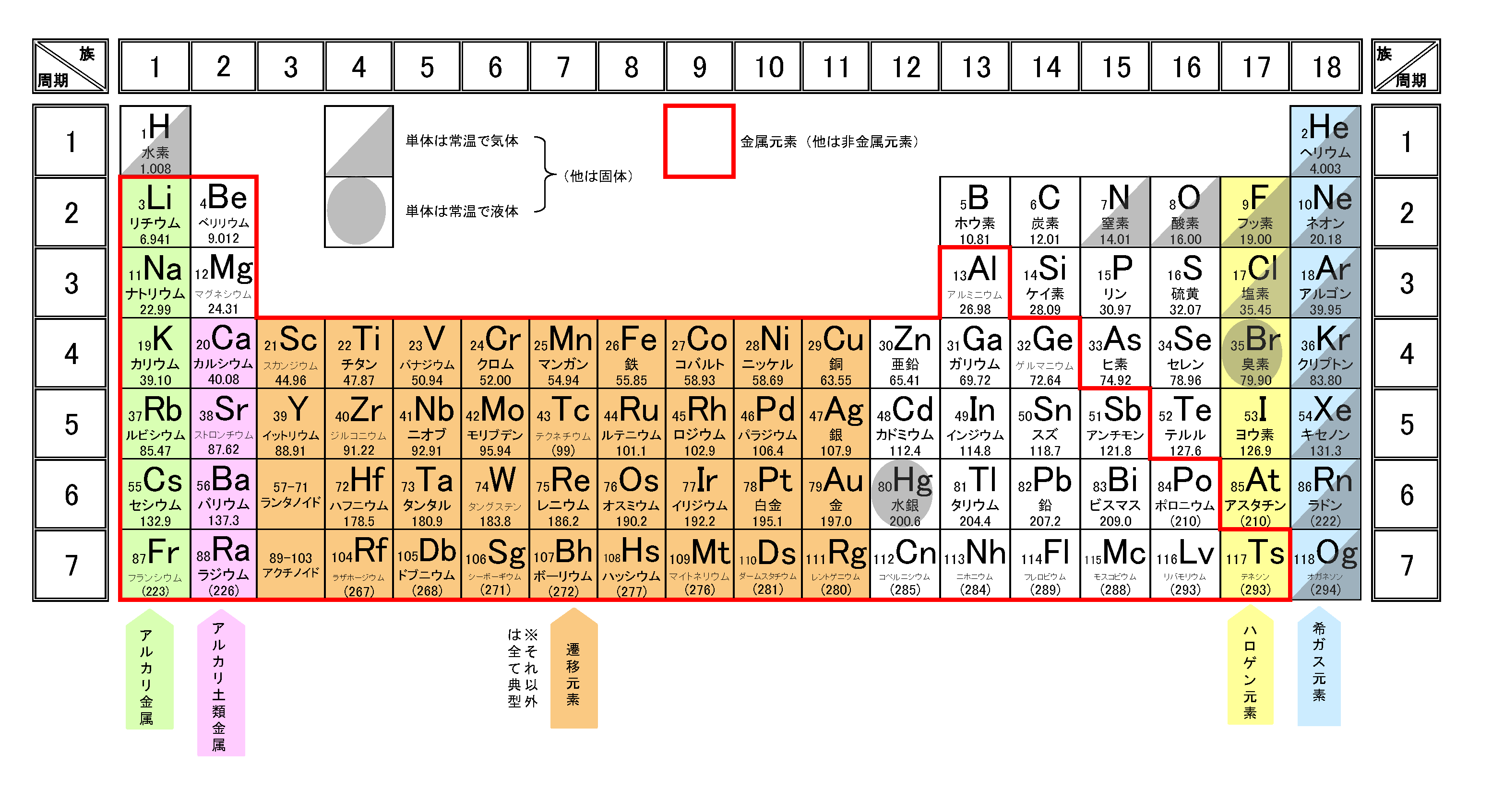



完全版 周期表の語呂合わせの覚え方と族 縦 や周期 横 の見方 サイエンスストック 高校化学をアニメーションで理解する



化学についての質問です 価電子数の求めかたが全然わかりません 至急詳 Yahoo 知恵袋




価電子数と同じ電子配置の希ガス原子をどう求めるのかわかりません Clear



理論 電子配置と電子軌道 受験 定期テストで高校化学を完全攻略




12 号 触媒 Astamuse



Q Tbn And9gcsehw5cwcaw6di4o3vedvsm7lzfqsols7n4fsxrmqq C2oljibh Usqp Cau



なんとなくわかる高校化学 周期表 族と周期



車山高原レア メモリーが語る 元素の周期表



1



原子とイオン




周期表で縦に並ぶ 同族元素 を元研究員がわかりやすく解説 Study Z ドラゴン桜と学ぶwebマガジン




原子価とは 原子価の求め方までわかりやすく解説 高校生向け受験応援メディア 受験のミカタ



希土類元素 レアアース とその発光の原理とは ファイバーラボ株式会社




受験生 高校生必見 周期表の覚え方 スイヘーリーベだけじゃナンセンス めんまのつぶやき




価電子とは 価電子数の数え方をやさしく説明するよ 授業 レベルa2 ともよし塾 受験と科学の解説授業
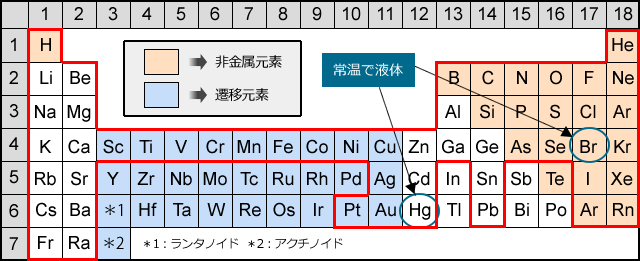



化学講座 第3回 元素の周期表 私立 国公立大学医学部に入ろう ドットコム



なんとなくわかる高校化学 価電子



化学講座 第3回 元素の周期表 私立 国公立大学医学部に入ろう ドットコム



周期表とその見方 戻る 性質のよく似た元素が縦の列に並ぶように整理した表を周期表といいいます 元素の整理 族と周期 同族元素 電子の配置と価電子 価電子とは 最外殻電子の数 4 7 価電子の数 4 7 価電子 最外殻にある1から7個の電子 内側からn
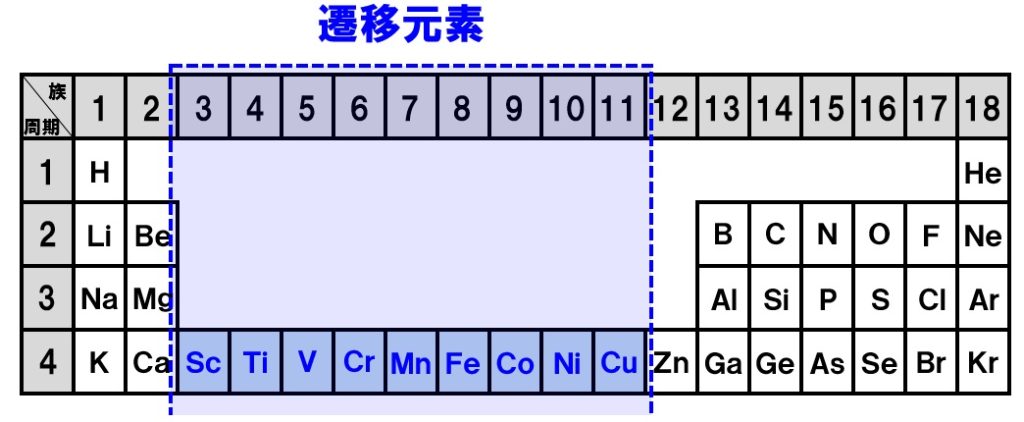



無機化学 遷移元素 3属 11族元素の特徴 Tekibo



受験基礎化学 6 電子配置 みかみの参考書ブログ



Http Www Lst Hokkai S U Ac Jp Kubo Pdf Mat3 Pdf



原子とイオン



イオン



1 4 電子殻と電子配置 おのれー Note



第2周期元素 Period 2 Element Japaneseclass Jp



化学 金属元素と周期表 技術情報館 Sekigin 金属元素の分子軌道 即ち電子配置 自由電子の状態と周期表との関連を紹介



科学 化学 Pararinpoppin In Hell



化学 金属元素と周期表 技術情報館 Sekigin 金属元素の分子軌道 即ち電子配置 自由電子の状態と周期表との関連を紹介




2 希土類元素 ランタノイド




5分でわかる 陽イオン 陰イオン 単原子イオン の価数の考え方と覚え方 電子配置を図で解説 サイエンスストック 高校化学をアニメーションで理解する



周期表 化学基礎 高校化学net参考書




原子価とは 原子価の求め方までわかりやすく解説 高校生向け受験応援メディア 受験のミカタ



元素の周期表 教科書 P 元素を 原子番号 順に並べる 性質の良く似た元素がある周期で現れる 元素の周期律 周期表 Ppt Download




遷移元素 Wikipedia




なぜヘリウムは電子の数か2個なのに価電子は0個なんですか なぜヘリ 高校 教えて Goo



2章a 類題1 1 0002 Top A 問題 次の文を読んで下の各問いに答えなさい 物質の基本 ア である元素の形成過程は次のように考えられている イ 億年前の宇宙創生の ウ から数万年後にまず軽元素の エ などが形成され その後 星の誕生 成長 爆発



化学重要問題集8 11 原子 イオン Tekibo



元素の分類 化学基礎 高校化学net参考書




価電子数を求める方法 12 ステップ 画像あり Wikihow



Http Heian Gacco Que Jp Haitisyuukikaitou Pdf



Q Tbn And9gcsehw5cwcaw6di4o3vedvsm7lzfqsols7n4fsxrmqq C2oljibh Usqp Cau




原子構造と電子配置 価電子 理系ラボ



1 6 元素の周期律と周期表 おのれー Note




1 2 周期表 その2 高校生 化学のノート Clear



1 6 元素の周期律と周期表 おのれー Note



5分でわかる 原子価の意味と一覧 価電子 価標の違い を図で徹底解説 サイエンスストック 高校化学をアニメーションで理解する



周期表とその見方 戻る 性質のよく似た元素が縦の列に並ぶように整理した表を周期表といいいます 元素の整理 族と周期 同族元素 電子の配置と価電子 価電子とは 最外殻電子の数 4 7 価電子の数 4 7 価電子 最外殻にある1から7個の電子 内側からn



危険物資格取得のための高校化学no 07 元素の周期表 F M サイエンスブログ




化学 化学基礎 補講 Labo




原子価とは 原子価の求め方までわかりやすく解説 高校生向け受験応援メディア 受験のミカタ




高校化学基礎 周期律と価電子 映像授業のtry It トライイット



1 4 電子殻と電子配置 おのれー Note




B 原子の電子配置と周期律



See How To Solve It At Qanda
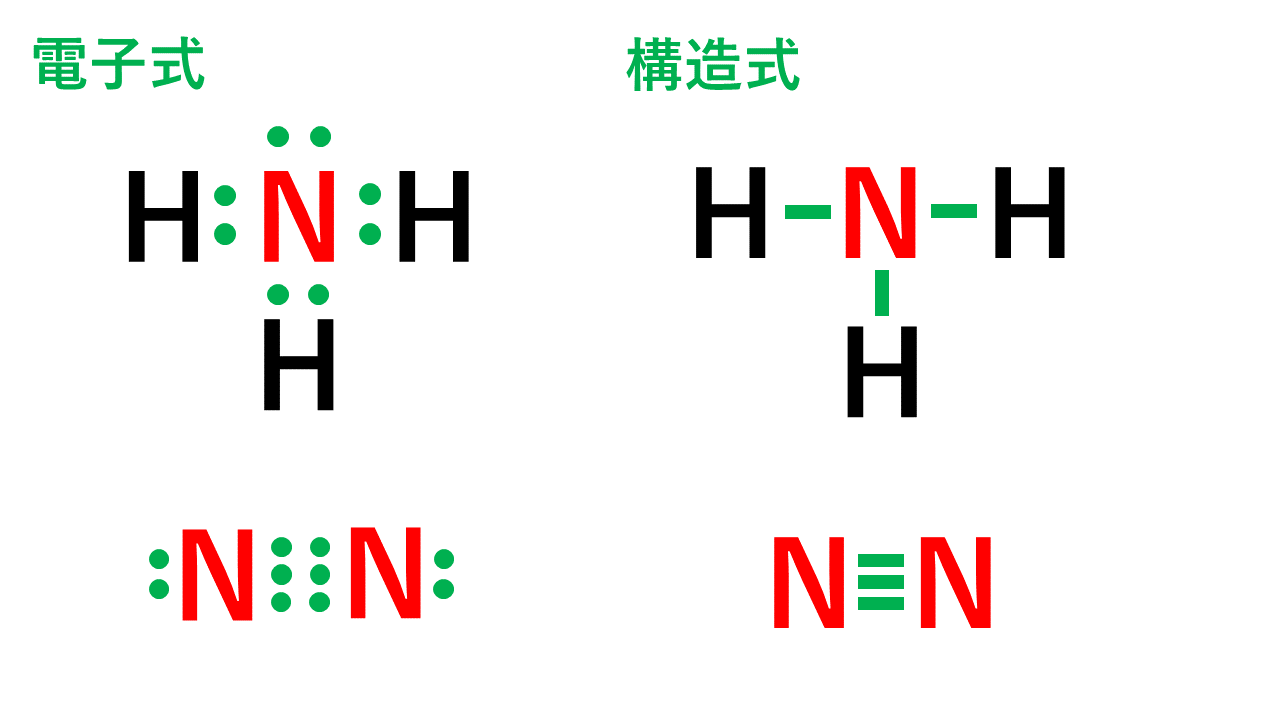



原子価の意味と一覧 価電子 価標の違い Vicolla Magazine



Http Www Lst Hokkai S U Ac Jp Kubo Pdf Mat3 Pdf
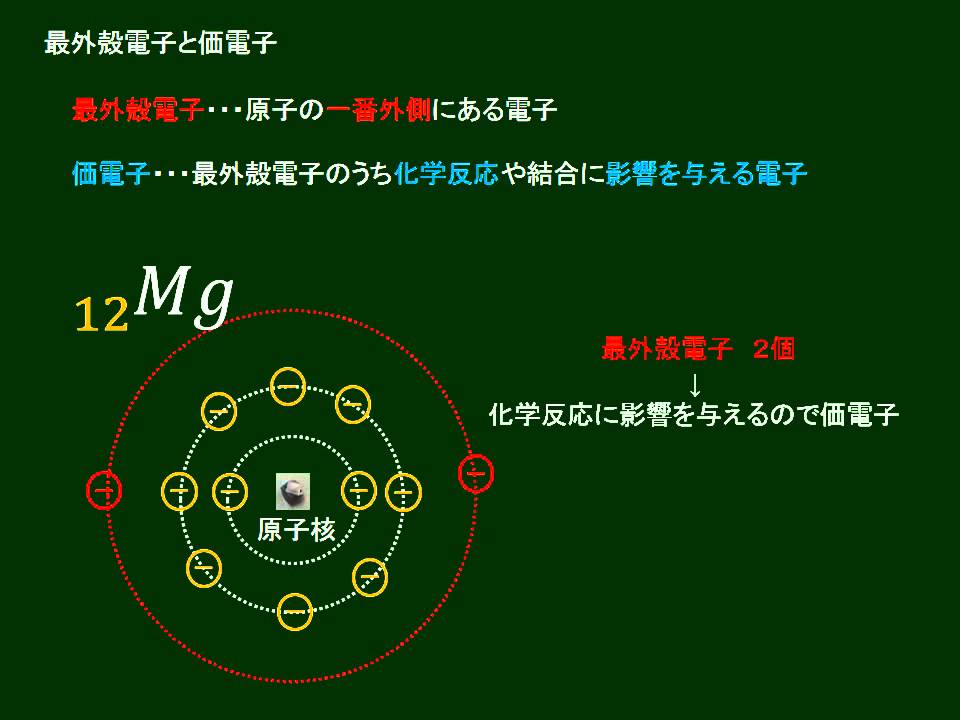



化学基礎 最外殻電子と価電子 Youtube



Http Heian Gacco Que Jp Haitisyuukikaitou Pdf
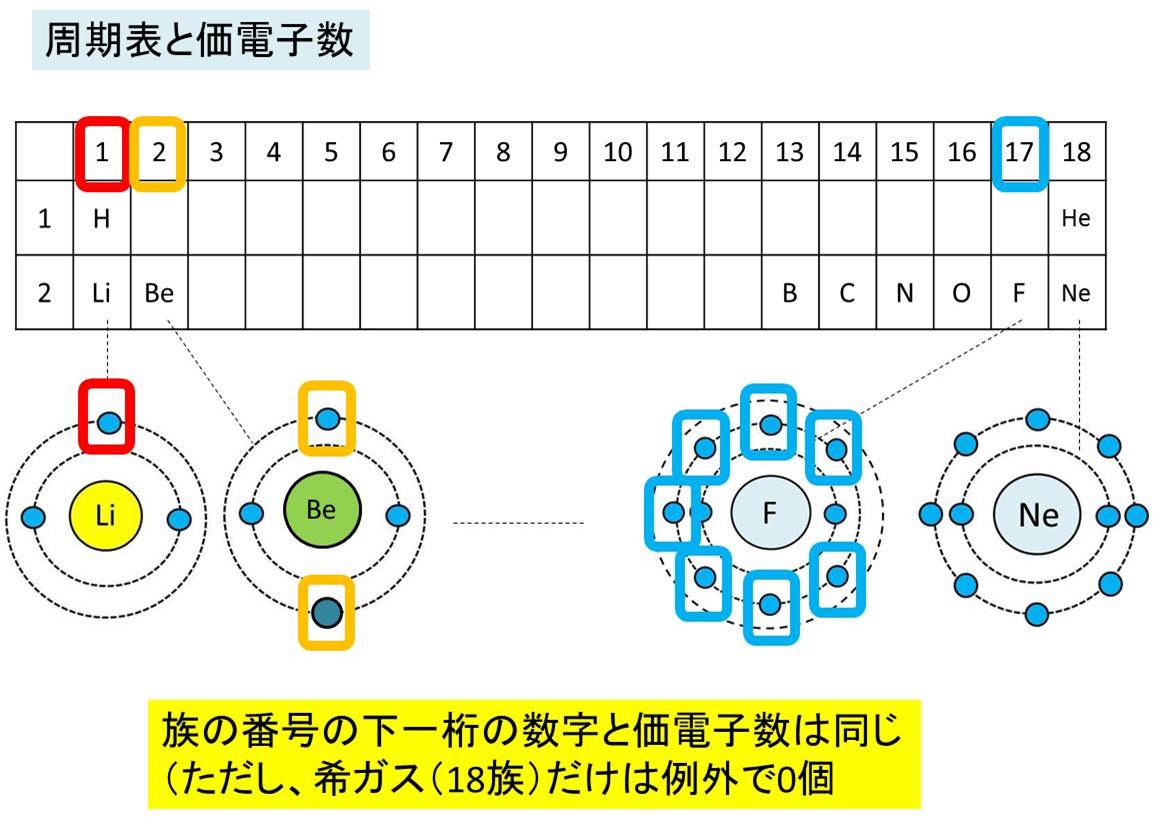



価電子とは 数え方や覚え方 最外殻電子との違いは




希ガスの電子配置は価電子ゼロの閉殻であっていますか Clear



非金属 水浄化フォーラム 科学と技術
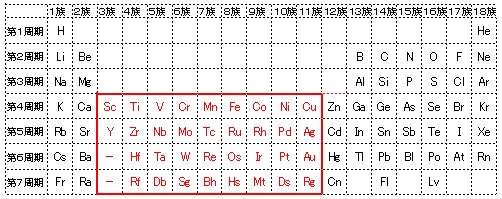



遷移元素の特徴とは 具体的な元素名と性質




環化 原子と元素 周期表 札幌カフェ部 活動報告




価電子数を求める方法 12 ステップ 画像あり Wikihow




2 See How To Solve It At Qanda
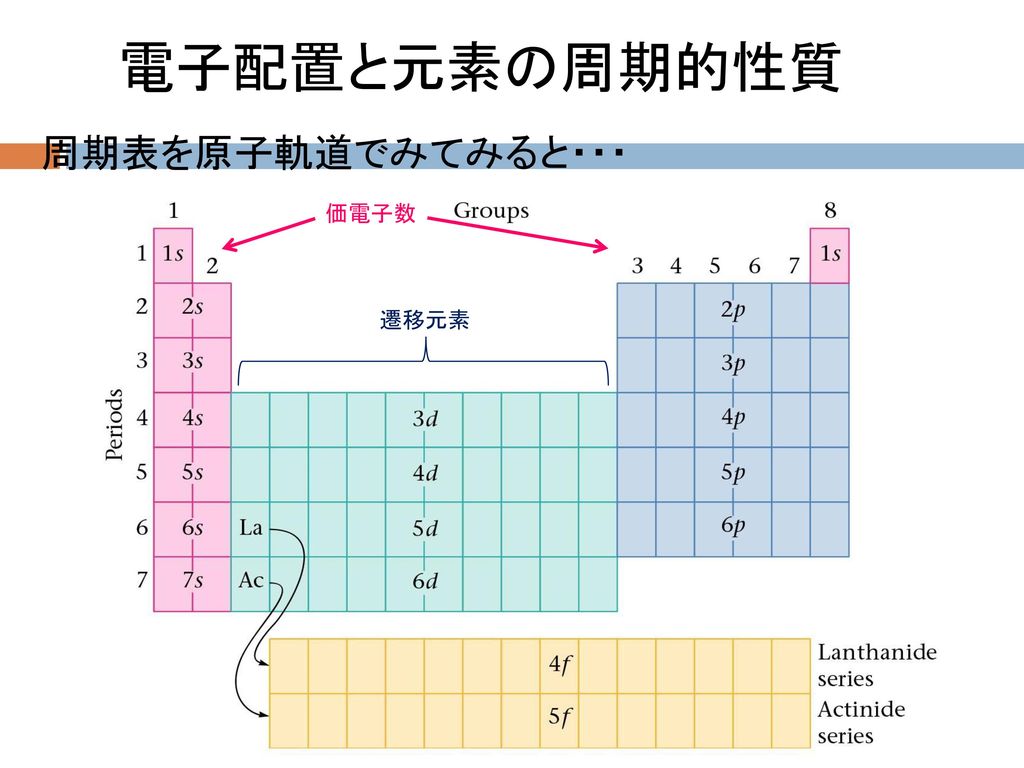



教養の化学 第7週 13年11月4日 担当 杉本昭子 Ppt Download
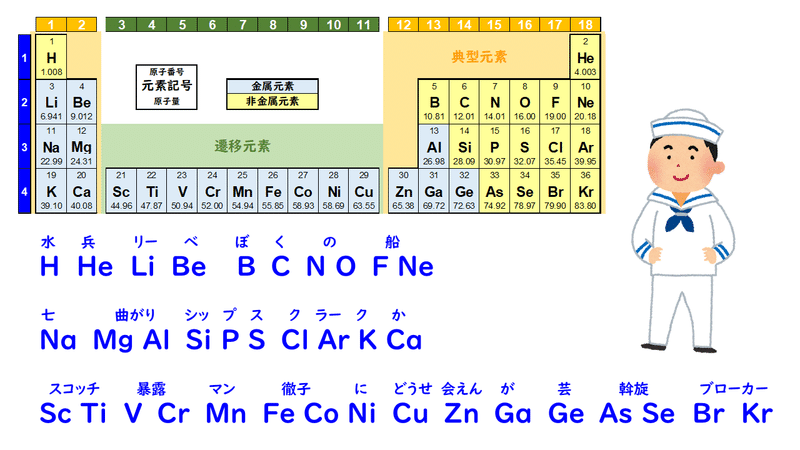



1 6 元素の周期律と周期表 おのれー Note




価電子数と同じ電子配置の希ガス原子をどう求めるのかわかりません Clear




周期表 Wikipedia




共有結合を即理解 わかりやすい図で解説 高校生向け受験応援メディア 受験のミカタ




価電子とは 周期表との関係 ゼロからの化学基礎




4 7 Descubre Como Resolverlo En Qanda




化学基礎 物質の構成 価電子 10分 Youtube
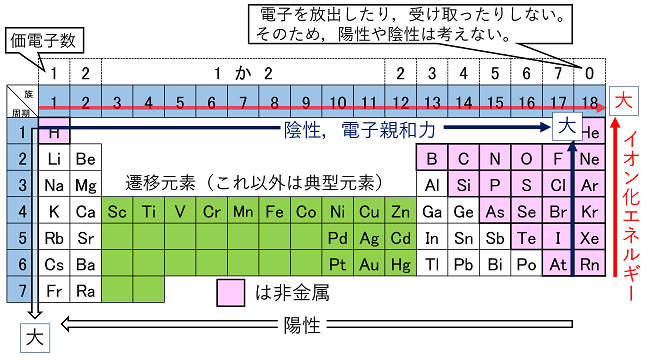



元素の種類と周期表 水素 貴ガス




高校化学基礎 周期律と価電子 映像授業のtry It トライイット
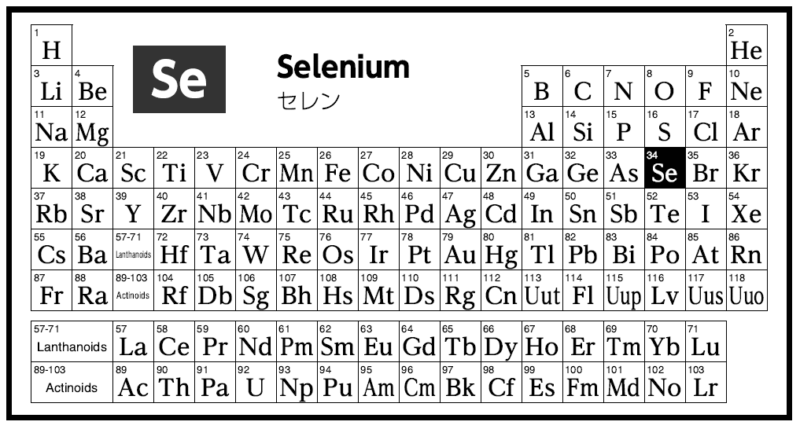



たくさんの価数をもつ元素 セレン Se
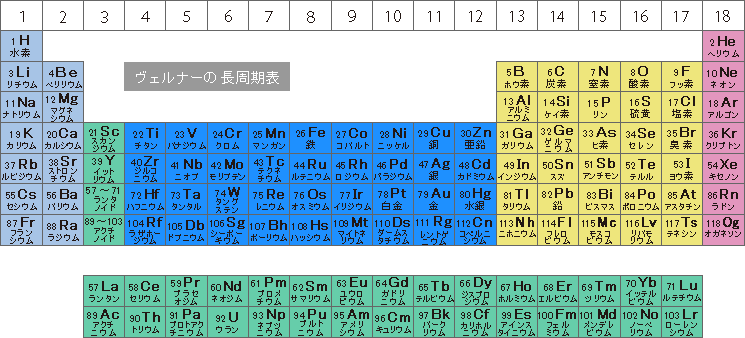



エレメンタッチって何 元素の立体周期表 Elementouch エレメンタッチ




元素に規則性を見つけたメンデレーエフの周期表をわかりやすく元研究員が解説 ページ 2 3 Study Z ドラゴン桜と学ぶwebマガジン
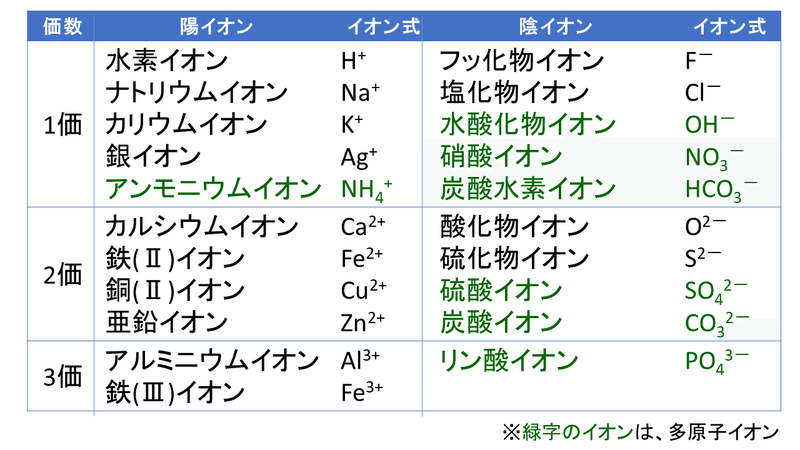



1 5 イオンの生成 おのれー Note


コメント
コメントを投稿